重症筋無力症
「筋と自己免疫」研究紹介
重症筋無力症
キーワード:抗Kv1.4抗体,胸腺腫,心筋炎,非運動症状,Japan MG registry
重症筋無力症 (myasthenia gravis, MG) は神経・筋接合部における臓器特異的自己免疫疾患です.アセチルコリン受容体あるいは筋特異的チロシンキナーゼに対する自己抗体が診断には必須ですが,MGではそれ以外の自己抗体も知られています.私は2005年に,横紋筋肉腫細胞を抗原とした蛋白免疫沈降法を確立し,電位依存性カリウムチャネル(Kv1.4)に対する自己抗体を発見しました.抗Kv1.4抗体は胸腺腫関連MGで高頻度であり,球症状やクリーゼを呈する重症MGに検出されます.またMGの経過中に致死的不整脈を起こすような心筋炎の疾患マーカーとなります.MGは致死的な疾患ではありませんので,患者さんの生命予後を左右する病態である点は重要です.
MGは易疲労感や筋力低下などの骨格筋の症状が中心ですが,その他にも多彩な症状が出現します.特に胸腺腫関連MGでは運動症状以外にも辺縁系脳炎,神経性筋強直,赤芽球癆,円形脱毛,免疫不全,心筋炎,味覚障害など胸腺腫由来のT細胞機能異常に基づく様々な病態が認められます(図1).私はMGの症状とは異なる一連の病態を「MGにおける非運動症状 (non-motor symptoms)」と考えています.MGの非運動症状は多くの臓器にまたがり,患者さんのQOLを低下させる症状から生命をおびやかす疾患まで多岐にわたっています.
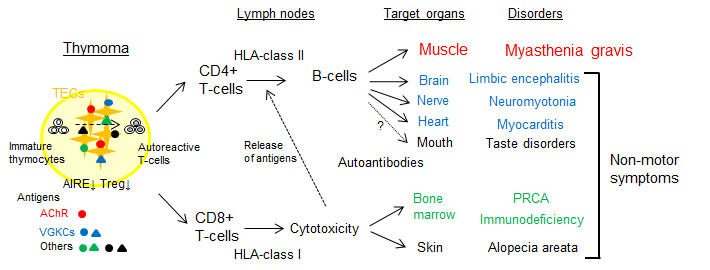
慶應義塾大学病院での診療では,専門外来を開設し350名のMG患者さんの経過観察を行っています.患者さんのQOLを重視し,日々診療に診療を行っています.多施設共同研究では症候,診断,治療,QOLなどMG患者さんからの視点から多くの研究テーマに取り組んできました.データに基づく良質なMG治療の実践を目標とする”Japan MG registry group” (http://mg.kenkyuukai.jp)を展開し,またMG治療の発展のために多くの治験にも参加しています.
【主な業績】 ※鈴木重明准教授よりご報告
- Suzuki S, Utsugisawa K, Nagane Y, et al. Classification of myasthenia gravis based on autoantibodies status. Arch (JAMA) Neurol 64: 1121-1124, 2007
- Suzuki S, Utsugisawa K, Yoshikawa H, et al. Autoimmune targets of heart and skeletal muscles in myasthenia gravis. Arch (JAMA) Neurol 66: 1134-1138, 2009
- Suzuki S, Utsugisawa K, Suzuki N. Overlooked non-motor symptoms in myasthenia gravis. J Neurol Neurosurg Psychiatry, 84: 989-994, 2013
- Suzuki S, Baba A, Kaida K, et al. Cardiac involvements in myasthenia gravis associated with anti-Kv1.4 antibodies. Eur J Neurol 21: 223-230, 2014
- Konno S, Suzuki S, Masuda M, et al. Association between glucocorticoid-induced osteoporosis and myasthenia gravis: a cross-sectional study. PLoS One 10: e0126579, 2015
- Kanai T, Uzawa A, Sato Y, et al. A clinical predictive score for postoperative myasthenic crisis. Ann Neurol 82: 841-849, 2017
- Nishida Y, Takahashi YK, Kanai T, et al. Safety of tapering tacrolimus dose in patients with well-controlled anti-acetylcholine receptor antibody-positive myasthenia gravis. Eur J Neurol 27: 100-104, 2020
- Oyama M, Okada K, Masuda M, et al. Suitable indications of eculizumab for patients with refractory generalized myasthenia gravis. Ther Adv Neurol Disord 13:1756286420904207, 2020
炎症性筋疾患
キーワード:自己抗体,免疫介在性壊死性ミオパチー (IMNM),抗SRP抗体,抗HMGCR抗体,抗ARS抗体,筋炎の統合的診断研究
炎症性筋疾患(筋炎)は免疫学的機序により筋線維が障害される疾患の総称で,さまざまな病態機序を背景にもつ疾患のあつまりです.私は国立精神・神経医療研究センター神経研究所疾病研究第一部と共同で「筋炎の統合的診断研究」を展開し,自己抗体から診断に貢献してきました。これまで,自己抗体を切り口として炎症性筋疾患の診断,病型分類,治療などについて研究を進め,その臨床的意義を解明してきました.
一般的には「筋炎特異的自己抗体」と「筋炎関連自己抗体」に分類されています.近年,あらたな自己抗体の登場や疾患概念の変遷から,再検討すべき時期にきております.すでに20以上の自己抗体が報告されており,炎症性筋疾患の60%-80%でいずれかの自己抗体が検出されると推測されます.私は炎症性筋疾患の自己抗体を免疫介在性壊死性ミオパチー (immune-mediated necrotizing myopathy, IMNM)に関連した自己抗体,アミノアシルtRNA合成酵素 (aminoacyl transfer RNA synthetase, ARS)に対する自己抗体,皮膚筋炎に関連した自己抗体に分けることを提唱しています(図2).
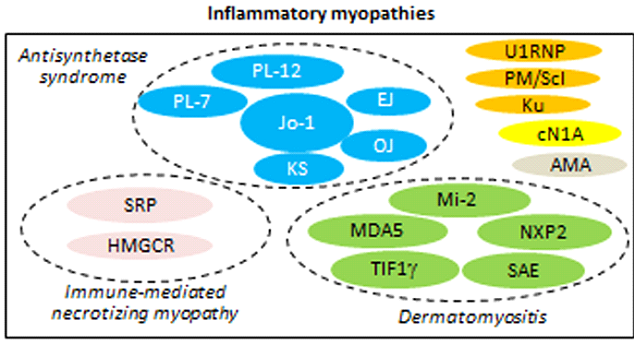
IMNMの診断にはシグナル認識粒子 (signal recognition particle, SRP) に対する自己抗体と3-hydroxy-3-methylglutary-coenzyme A reductase (HMGCR)に対する自己抗体の測定が重要です.特定のHLAに関連し,加えてスタチン,悪性腫瘍,膠原病などが発症リスクとなります.IMNM関連自己抗体を定量的に測定するELISAを樹立し,現在,コスミックコーポレーションで受託測定(抗SRP抗体と抗HMGCR抗体)を行っています (https://www.cosmic-jpn.co.jp/contractservice).
多くの自己抗体が存在することは,臨床医の先生にとって「どの抗体を測定したらいいのか?」と混乱を招く状況になっているものと思います.これらの自己抗体を一括して測定できるシステムがあればいいのですが,現実的には一部が保険収載であり,その他は受託測定や一部(海外)の研究室でしか測定できないものがあるのが難点です.我々の施設では,多くの自己抗体を発見するのに役立ったRNA免疫沈降法による測定法を継続しています.
【主な業績】
- Suzuki S, Satoh T, Sato S, et al. Clinical utility of anti-signal recognition particle antibody in the differential diagnosis of myopathies. Rheumatology 47: 1539-1542, 2008
- Suzuki S, Hayashi YK, Kuwana M, et al. Myopathy associated with antibodies to signal recognition particle: disease progression and neurological outcome. Arch (JAMA) Neurol 69: 728-732, 2012
- Suzuki S, Yonakawa T, Kuwana M, et al. Clinical and histological findings associated with autoantibodies detected by RNA immunoprecipitation. J Neuroimmunol 274: 202-208, 2014
- Suzuki S, Nishikawa A, Kuwana M, et al. Inflammatory myopathy with anti-signal recognition particle antibodies: case series of 100 patients. Orphanet J Rare Dis 10: 61, 2015
- Ohnuki Y, Suzuki S, Shiina T, et al. HLA-DRB1 Alleles in immune-mediated necrotizing myopathy. Neurology 87: 1954-1955, 2016
- Watanabe Y, Uruha A, Suzuki S, et al. Clinical features and prognosis in anti-SRP and anti-HMGCR necrotizing myopathy. J Neurol Neurosurg Psychiatry 87: 1038-1044, 2016
- Uruha A, Nishikawa A, Tsuburaya RS, et al. Sarcoplasmic MxA expression — a valuable marker of dermatomyositis. Neurology 88: 493-500, 2017
- Suzuki S, Uruha A, Suzuki N, Nishino I. Integrated Diagnosis Project for Inflammatory Myopathies: An association between autoantibodies and muscle pathology. Autoimmun Rev 16: 693-700, 2017
- Noguchi E, Uruha A, Suzuki S, et al. Skeletal muscle involvement in antisynthetase syndrome. JAMA Neurol 74: 992-999, 2017
- Oyama M, Holzer MT, Ohnuki Y, et al. Neurology. 102: e209268, 2024
https://www.keio.ac.jp/ja/press-releases/files/2024/3/29/240329-2.pdf
免疫関連有害事象
キーワード:免疫チェックポイント阻害薬,PD-1 myopathy,抗横紋筋抗体
抗programmed cell death 1 (PD-1)抗体であるニボルマブが,2014年に悪性黒色腫に対して承認されて以降,抗CTLA-4抗体イピリムマブ,抗PD-1抗体ペムブロリズマブ,抗PD-L1抗体である3つのアベルマブ,アテゾリツマブ,デュルバルマブが相次いで承認されています.適応となるがん腫も,非小細胞肺がん,腎細胞がん,頭頸部がん,ホジキンリンパ腫,胃がん,尿路上皮がん,メルケル細胞がんに拡大されており,これらの免疫チェックポイント阻害剤で治療をうけるがん患者さんはますます増加するのは確実です.
免疫チェックポイント阻害剤が広く使われるようになるにつれ,免疫関連有害事象 (immune-related adverse events, irAE)の管理はより重要になってきます.あらゆる臓器においてirAEは発症しますが,神経・筋に関連したirAEは1-2%と頻度が少ない上,多彩な疾患が起こる可能性があります.また薬剤と関係のない一般的な臨床特徴と異なり,急速に症状が進行し,重篤な場合があります.
私は日本臨床腫瘍学会のirAEガイドラインの委員や免疫チェックポイント阻害剤を扱っている製薬会社の副作用対策委員を拝命しております.また多方面の学会における教育講演やシンポジウムでirAEについてお話する機会をいただいております.がん専門医やコンサルテーションを受ける先生方への適切な理解につながり,微力ではありますが安全ながん治療にお役にたてるよう活動しております.2017年には,オプジーボが原因で発症するMGに関する論文を発表し,多くの新聞で取り上げていただきました(図3).

神経・筋に関連したirAEの中でも,筋炎とMGの特徴を有する”PD-1myopathy”に注目しています.抗横紋筋抗体が診断や病態に関与している可能性を考え,研究をすすめています.2019年,抗横紋筋抗体(抗titin抗体と抗Kv1.4抗体)を高い感度と定量可能なflow cytometryとcell-based assay (CBA)を組みあわせたcytometric CBAによる測定法を開発しました.現在,TKリサーチ社で受託測定を行っております (http://www.tkresearch.co.jp/products/cytometric-cba-antistriationalab).
【主な業績】
- Suzuki S, Ishikawa N, Konoeda F, et al. Nivolumab-related myasthenia gravis with myositis and myocarditis in Japan. Neurology 89: 1127-1134, 2017
- Takamatsu K, Nakane S, Suzuki S, et al. Immune checkpoint inhibitors in the onset of myasthenia gravis with hyperCKemia. Ann Clin Trans Neurol 5: 1421-1427, 2018
- Kufukihara K, Watanabe Y, Inagaki T, et al. Cytometric cell-based assays for anti-striational antibodies in myasthenia gravis with myositis and/or myocarditis. Sci Rep 9: 5284, 2019
- Seki M, Uruha A, Ohnuki Y, et al. Inflammatory myopathy associated with PD-1 inhibitors. J Autoimmun 100: 105-113, 2019
- Matsubara S, Seki M, Suzuki S, et al. Tertiary lymphoid organs in the inflammatory myopathy associated with PD-1 inhibitors. J Immunother Cancer 7: 256, 2019
